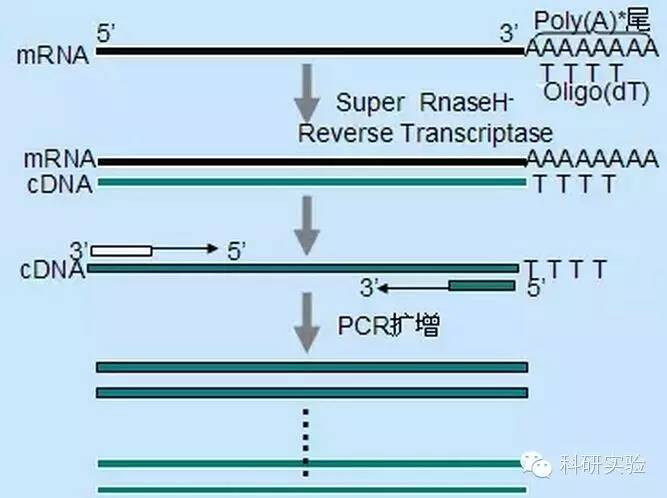
Ⅰ. Povečajte občutljivost reakcijskega sistema:
1. Ločite visoko kakovostno RNA:
Uspešna sinteza cDNA prihaja iz visokokakovostne RNA.Kakovostna RNA bi morala zagotavljati vsaj skupno daljšo in ne vsebuje inhibitorjev, ki ne vsebujejo zapisovalnih encimov, kot sta EDTA ali SDS.Kakovost RNA določa največjo vrednost informacije o zaporedju, ki jo lahko prepišete v cDNA.Splošna metoda čiščenja RNA je stopenjska metoda z uporabo izoocianata/acidofenola.Da bi preprečili onesnaženje z RNazo, je za RNK, ločeno od vzorca, bogatega z RNazo (kot je trebušna slinavka), potrebno shranjevanje formaldehida, da se shrani visokokakovostna RNK, kar še bolj velja za dolgoročno shranjevanje.RNK, ekstrahirana iz podganjih jeter, se je v bistvu razgradila po enem tednu shranjevanja v vodi, medtem ko je RNA, ekstrahirana iz podganje vranice, ostala stabilna po treh letih shranjevanja v vodi.Poleg tega so transkripti, večji od 4 kb, bolj občutljivi na razgradnjo RNaze v sledovih kot majhni transkripti.Da bi povečali stabilnost vzorca RNA za shranjevanje, lahko RNA raztopimo v ionskem metalminu in shranimo pri -70 °C.Tilid, ki se uporablja za shranjevanje RNK, ne sme vsebovati raznih predmetov, ki razgrajujejo RNK.RNA, ki je pridobljena iz trebušne slinavke, se lahko hrani v metalmaminu vsaj eno leto.Ko ste pripravljeni na uporabo RNA, lahko uporabite naslednje metode za obarjanje RNA: dodajte NaCl do 0,2 ml in 4-kratno prostornino etanola, postavite na sobno temperaturo 3-5 minut in 10.000 × g centrifugirajte 5 minut.
2. Uporabite reverzno transkriptazo brez aktivnosti RNaseH (RNaseH-):
Zaviralci RNaze se pogosto dodajo reakcijam povratne transkripcije, da se poveča dolžina in izkoristek sinteze cDNA.Inhibitor RNaze je dodan v prvi reakciji verižne sinteze v prisotnosti pufrov in redukcijskih sredstev, kot je DTT, ker postopek sinteze pred cDNA denaturira inhibitor, s čimer se sprostijo vezane RNaze, ki razgradijo RNK.Inhibitor proteinske RNaze preprečuje samo razgradnjo RNK z RNazo A, B, C in ne preprečuje RNaze na koži, zato je treba paziti, da kljub uporabi teh inhibitorjev ne vnesete RNaze s prstov.
Reverzna transkriptaza katalizira pretvorbo RNA v cDNA.Tako M-MLV kot AMV imata poleg lastne polimerazne aktivnosti endogeno aktivnost RNaseH.Aktivnost RNAseH tekmuje z aktivnostjo polimeraze za heterozigotne verige, ki nastanejo med predlogami RNA in primerji DNA ali podaljški pramenov cDNA, in razgradi verige RNA: RNA v kompleksih DNA.Predloge RNA, razgrajene z aktivnostjo RNAseH, se ne morejo več uporabljati kot učinkoviti substrati za sintezo cDNA, kar zmanjšuje izkoristek in dolžino sinteze cDNA.Tako bi bila odprava ali močno zmanjšanje aktivnosti RNaseH reverzne transkriptaze zelo koristno.
SuperScriptⅡ reverzna transkriptaza, MMLV reverzna transkriptaza RNaseH- in thermoScript reverzna transkriptaza, AMV RNaseH- sta dali več cDNA polne dolžine kot MMLV in AMV.Na občutljivost RT-PCR vpliva količina sintetizirane cDNA.ThermoScript je veliko bolj občutljiv kot AMV.Velikost produktov RT-PCR je omejena s sposobnostjo reverzne transkriptaze, da sintetizira cDNA, zlasti pri kloniranju večjih Cdna.V primerjavi z MMLV je SuperScripⅡ znatno povečal izkoristek dolgih produktov RT-PCR.Reverzna transkriptaza RNaseH- poveča tudi toplotno stabilnost, zato lahko reakcijo izvedemo pri temperaturah, ki so višje od običajnih 37-42 ℃.Pri predlaganih pogojih sinteze so bili uporabljeni oligo(dT) primerji in 10μCi [alpha-p]dCTP.Skupna proizvodnja prve verige je bila izračunana z metodo TCA precipitacije.Celotno dolžino cDNA smo analizirali z odstranjevanjem trakov po velikosti in štetjem v alkalnem agaroznem gelu.
3. Povečajte temperaturo ohranjanja toplote povratne transkripcije:
Višja zadrževalna temperatura pomaga odpreti sekundarno strukturo RNA in povečati izkoristek reakcije.Pri večini predlog RNK držanje RNK in primerja pri 65 °C brez pufra ali soli in ju nato hitro ohladitev na ledu odstrani večino sekundarnih struktur in omogoči vezavo primerjev.Vendar imajo nekatere predloge še vedno sekundarno strukturo, tudi po toplotni denaturaciji.Pomnoževanje teh težavnih predlog se lahko izvede z uporabo reverzne transkriptaze ThermoScript in s postavitvijo reakcije reverzne transkriptaze pri višjih temperaturah za izboljšanje pomnoževanja.Višje temperature zadrževanja lahko tudi povečajo specifičnost, zlasti če se sinteza cDNA izvaja z uporabo gensko specifičnih primerjev (GSPS) (glejte poglavje 3).Če uporabljate GSP, se prepričajte, da je vrednost Tm temeljnega premaza enaka pričakovani temperaturi zadrževanja.Ne uporabljajte oligo(dT) in naključnih primerjev nad 60 ℃.Naključne primerje je treba hraniti pri 25 ℃ 10 minut, preden se temperatura poveča na 60 ℃.Poleg uporabe višjih temperatur reverzne transkripcije je mogoče izboljšati specifičnost z neposrednim prenosom mešanice RNA/primerja s temperature denaturacije 65 ℃ na temperaturo zadrževanja reverzne transkripcije in dodajanjem predhodno segrete 2× reakcijske zmesi (sinteza termične iniciacije cDNA).Ta pristop pomaga preprečiti medmolekularno združevanje baz, ki se pojavi pri nižjih temperaturah.Uporaba instrumenta PCR poenostavi številna temperaturna stikala, potrebna za RT-PCR.
Tth toplotno stabilizirana polimeraza deluje kot DNA polimeraza v prisotnosti Mg2+ in RNA polimeraza v prisotnosti Mn2+.Lahko zadrži toploto do 65 ℃.Vendar pa prisotnost Mn2+ med PCR zmanjša natančnost, zaradi česar je polimeraza Tth manj primerna za visoko natančno pomnoževanje, kot je kloniranje cDNA.Poleg tega je Tth manj učinkovit pri reverzni transkripciji, kar zmanjša občutljivost, in ker lahko en sam encim izvaja reverzno transkripcijo in PCR, kontrolnih reakcij brez reverzne transkripcije ni mogoče uporabiti za razlikovanje pomnoženih produktov cDNA od produktov kontaminirane genomske DNA.
4. Dodatek, ki spodbuja obratno prepisovanje:
Dodatek aditivov, vključno z glicerinom in DMSO, v prvo verižno sintezno reakcijo lahko zmanjša stabilnost dvojne verige nukleinske kisline in sprosti sekundarno strukturo RNA.Dodate lahko do 20 % glicerina ali 10 % DMSO, ne da bi to vplivalo na aktivnost SuperScriptⅡ ali MMLV.AMV lahko prenese tudi do 20 % glicerola brez zmanjšanja aktivnosti.Za povečanje občutljivosti RT-PCR v reakciji reverzne transkripcije SuperScriptⅡ lahko dodamo 10 % glicerola in ga izoliramo pri 45 ℃.Če PCR dodamo 1/10 produkta reakcije retrotranskripcije, je koncentracija glicerola v reakciji pomnoževanja 0,4 %, kar ni dovolj za zaviranje PCR.
5. Obdelava RNAseH:
Občutljivost je mogoče izboljšati z obdelavo reakcij sinteze cDNA z RNaseH pred PCR.Za nekatere predloge se domneva, da RNA v reakciji sinteze cDNA preprečuje vezavo pomnoženih produktov, v tem primeru lahko zdravljenje z RNAseH poveča občutljivost.Na splošno je zdravljenje z RNaseH potrebno za pomnoževanje relativno dolge ciljne predloge cDNA polne dolžine, kot je tuberozna sherozaⅡ z nizko kopijo.Za to težavno predlogo je RNaseH izboljšala signal, ki ga je ustvarila cDNA, sintetizirana s SuperScriptⅡ ali AMV.Za večino reakcij RT-PCR je obdelava z RNAseH neobvezna, ker stopnja denaturacije PCR, izolirana pri 95 ℃, običajno hidrolizira RNA iz kompleksa RNA:DNA.
6. Izboljšane metode za odkrivanje majhnih količin RNA:
RT-PCR je še posebej zahtevna, ko so na voljo le majhne količine RNA.Dodatek glikogena kot nosilca med ločevanjem RNA pomaga povečati donos majhnih vzorcev.Hkrati s Trizolom se lahko doda glikogen brez RNaze.Glikogen je topen v vodi in lahko ostane v vodni fazi z RNA, da pomaga pri kasnejšem obarjanju.Priporočena koncentracija glikogena brez RNaze je 250 μg/ml za vzorce manj kot 50 mg tkiva ali 106 gojenih celic.
Dodatek acetiliranega BSA reakcijam povratne transkripcije z uporabo SuperScriptⅡ lahko poveča občutljivost, za majhne količine RNA pa lahko zmanjšanje količine SuperScriptⅡ in dodajanje 40 enot zaviralca nukleaze RnaseOut izboljša raven zaznave.Če se pri ločevanju RNK uporablja glikogen, je še vedno priporočljiv dodatek BSA ali inhibitorjev RNaze za reakcije povratne transkripcije z uporabo SuperScriptⅡ.
Ⅱ. Povečajte specifičnost RT-PCR
1. Sinteza cNDA:
Za začetek sinteze prve verige cDNA je mogoče uporabiti tri različne metode, relativna specifičnost vsake metode pa vpliva na količino in vrsto sintetizirane cDNA.
Metoda naključnega primerja je najmanj specifična od treh metod.Primerji se žarijo na več mestih v celotnem zapisu, da se proizvede kratka cDNA delne dolžine.Ta metoda se pogosto uporablja za pridobivanje 5' končnih zaporedij in cDNA iz RNA predlog s sekundarnimi strukturnimi regijami ali s končnimi mesti, ki jih reverzna transkriptaza ne more podvojiti.Za pridobitev najdaljše cDNA je treba empirično določiti razmerje med primerji in RNA v vsakem vzorcu RNA.Začetna koncentracija naključnih primerjev se giblje od 50 do 250 ng na 20 μl reakcijskega sistema.Ker je cDNA, sintetizirana iz celotne RNA z uporabo naključnih primerjev, večinoma ribosomska RNA, je poli(A)+RNA na splošno izbrana kot predloga.
Oligo(dT) iniciacija je bolj specifična kot naključni primerji.Hibridizira s poli(A) repom, ki ga najdemo na 3' koncu mRNA v večini evkariontskih celic.Ker poli(A)+RNA predstavlja približno 1 % do 2 % celotne RNA, sta količina in kompleksnost cDNA veliko manjši, kot če bi uporabili naključne primerje.Zaradi svoje visoke specifičnosti oligo(dT) na splošno ne zahteva optimizacije razmerja med RNA in primerjem in selekcije poli(A)+.Priporočena je uporaba 0,5 μg oligo(dT) na 20 μl reakcijskega sistema.oligo(dT)12-18 je primeren za večino RT-PCR.Sistem ThermoScript RT-PCR zagotavlja oligo(dT)20 zaradi svoje dobre toplotne stabilnosti in je primeren za višje temperature zadrževanja.
Gene-specifični primerji (GSP) so najboljši specifični primerji za korak povratne transkripcije.GSP je protismiselni oligonukleozid, ki lahko specifično hibridizira s ciljnimi sekvencami RNA, namesto da segreje vse Rna kot naključne začetnike ali oligo(dT).Pravila, uporabljena za načrtovanje primerjev PCR, veljajo tudi za načrtovanje reakcije reverzne transkripcije GSP.GSP je lahko enako zaporedje kot pomnoževalni primer, žarjen na koncu mRNA3', ali pa je GSP lahko zasnovan tako, da se žari navzdol s primerjem za obratno pomnoževanje.Za nekatere pomnožene objekte je treba oblikovati več kot en protismiselni primer za uspešno RT-PCR, ker lahko sekundarna struktura ciljne RNA prepreči vezavo primerja.Predlaga se uporaba 1 pmol protismiselnega GSP v prvem sistemu verižne sinteze 20 μl.
2. Povečajte temperaturo ohranjanja toplote povratne transkripcije:
Da bi v celoti izkoristili specifičnost GSP, je treba uporabiti reverzno transkriptazo z visoko toplotno stabilnostjo.Toplotno stabilno reverzno transkriptazo je mogoče izolirati pri višjih temperaturah, da se poveča strogost reakcije.Na primer, če je GSP žarjen pri 55 °C, potem specifičnost GSP ni v celoti izkoriščena, če se reverzna transkripcija izvede pri 37 °C z nizko strogostjo z uporabo AMV ali M-MLV.Vendar lahko SuperScripⅡ in ThermoScript reagirata pri 50 ℃ ali več, kar odpravlja nespecifične izdelke, proizvedene pri nižjih temperaturah.Za največjo specifičnost lahko zmes RNA/primerja prenesete neposredno s temperature denaturacije 65 ℃ na temperaturo zadrževanja reverzne transkripcije z dodatkom predhodno segrete 2x reakcijske zmesi (toplotna iniciacija sinteze cDNA).To pomaga preprečiti združevanje baz med molekulami pri nizkih temperaturah.Uporaba instrumenta PCR poenostavi številne temperaturne prehode, potrebne za RT-PCR.
3. Zmanjšajte kontaminacijo genomske DNK:
Ena možna težava pri RT-PCR je, da RNA kontaminira genomsko DNA.Uporaba boljših metod ločevanja RNA, kot je reagent Trizol, zmanjša kontaminacijo genomske DNA v pripravkih RNA.Da bi se izognili produktom, proizvedenim iz genomske DNA, lahko RNA obdelamo z Dnas stopnje pomnoževanja Ⅰ, da odstranimo kontaminirano DNA pred reverzno transkripcijo.Vzorce smo hranili pri 65 ℃ v 2,0 mM EDTA 10 minut, da smo prekinili razgradnjo DNazeⅠ.EDTA kelira magnezijeve ione, da prepreči hidrolizo RNA, odvisno od magnezijevih ionov, do katere pride pri visokih temperaturah.
Da bi ločili pomnoženo cDNA od produkta pomnoževanja genomske DNA, je mogoče oblikovati primerje, ki se žarijo ločeno z ločenim eksonom.Produkti PCR, pridobljeni iz cDNA, bodo krajši od tistih, pridobljenih iz kontaminirane genomske DNA.Na vsaki šabloni RNA se izvede tudi nadzorovan poskus brez reverzne transkripcije, da se ugotovi, ali je dani fragment iz genomske DNA ali cDNA.Produkti PCR, pridobljeni v odsotnosti reverzne transkripcije, izhajajo iz genoma.
Sorodni izdelek
RT-PCR Enostavnoᵀᴹjaz (en korak)
-Komplet v enem koraku omogoča izvedbo reverzne transkripcije in PCR v isti epruveti.Dodati mora samo šablonsko RNA, specifične primerje PCR in ddH brez RNaze2O.
- Kvantitativno analizo RNA v realnem času je mogoče izvesti hitro in natančno.
-Komplet uporablja edinstven reagent za reverzno transkripcijo Foregene in DNA polimerazo Foregene HotStar Taq v kombinaciji z edinstvenim reakcijskim sistemom za učinkovito izboljšanje učinkovitosti pomnoževanja in specifičnosti reakcije.
- Optimiziran reakcijski sistem omogoča višjo občutljivost reakcije, večjo toplotno stabilnost in boljšo toleranco.
RT Easy II (z GDNase) Glavni premiks za sintezo prve verige CDNA za PCR v realnem času z GDNase
-Učinkovita sposobnost odstranjevanja gDNA, ki lahko odstrani gDNA v predlogi v 2 minutah.
-Učinkovit sistem reverzne transkripcije, potrebuje le 15 minut za dokončanje sinteze prve verige cDNA.
- Kompleksne predloge: predloge z visoko vsebnostjo GC in kompleksno sekundarno strukturo je mogoče tudi obrniti z visoko učinkovitostjo.
- Visoko občutljiv sistem povratne transkripcije, predloge na ravni pg lahko pridobijo tudi visoko kakovostno cDNA.
-Sistem reverzne transkripcije ima visoko toplotno stabilnost, optimalna reakcijska temperatura je 42 ℃ in ima še vedno dobro delovanje reverzne transkripcije pri 50 ℃.
Čas objave: mar-07-2023